近日,课题组论文“Reverse QTY code design of active human serum albumin self-assembled amphiphilic nanoparticles for effective doxorubicin release in mice”在国际权威期刊《美国科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)上发表。该成果由课题组与上海交通大学微生物代谢国家重点实验室庆睿以及美国麻省理工学院Shuguang Zhang研究员等共同研究完成。我院为第一单位,博士生孟润为第一作者,郝石磊副教授、王伯初教授、庆睿副教授和Shuguang Zhang研究员为共同通讯作者。

QTY编码(QTY Code)是一种蛋白质重构技术,其中QTY分别是谷氨酰胺(Q),苏氨酸(T)和酪氨酸(Y)的简称,是2018年由美国麻省理工学院分子结构实验室发明(PNAS 115.37 (2018): E8652-E8659.)。其基于不同氨基酸的电子云密度图相似性,特异性地使用亲水性氨基酸替代疏水性氨基酸:天冬酰胺(N)和谷氨酰胺(Q)替代亮氨酸(L)、苏氨酸(T)替代异亮氨酸(I)和缬氨酸(V)、以及酪氨酸(Y)替代苯丙氨酸(F),可将水不溶性蛋白转化为水溶性蛋白,同时保留蛋白的空间折叠、生物活性与特异性结合能力。借助QTY编码已经成功构建超过15种膜蛋白的水溶性突变体,用于疾病治疗、生物传感等领域。作为一个简便易行的蛋白质设计工具,QTY编码是否可以反向使用,应用于增强蛋白质的疏水性是个值得研究的问题。
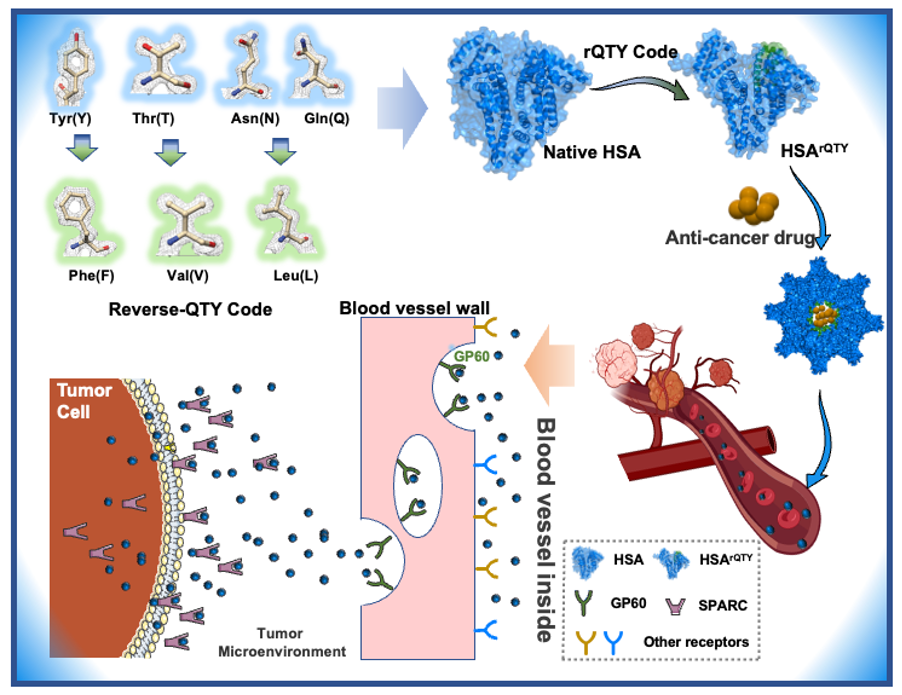
本工作首次证明了QTY编码的逆向可用性。血清白蛋白是人体血浆中含量最高的蛋白质。白蛋白因其良好的生物相容性、无毒和易于纯化等特点,是作为药物载体的良好选择。此外,白蛋白载体在肿瘤靶向治疗上具有独特的优势,由于肿瘤细胞表面存在白蛋白结合受体GP60,白蛋白纳米粒与GP60受体结合后进一步与caveolin-1结合,借助胞膜内陷产生转胞吞囊泡,使白蛋白纳米粒跨过内皮细胞;其进一步与肿瘤细胞中过表达的SPARC结合导致其在肿瘤内累积量增加。但白蛋白载体制备中常用的有机溶剂以及加热、凝聚等过程易导致蛋白变性,改变白蛋白在体内的递送途径。针对此问题,该研究使用反向QTY编码分别对人血清白蛋白的IB、IIB和IIIB区域进行疏水性增强改造,改造后的人血清白蛋白因两亲性具有自组装的效果,在温和条件下即可装载抗肿瘤药物,体内外实验证明设计的自组装白蛋白纳米粒的转运和吞噬行为受到GP60和SPARC的调控,且与去溶剂化法制备的人血清白蛋白纳米粒、牛血清白蛋白纳米粒以及临床使用的阿霉素产品相比,具有更优的抗肿瘤治疗效果。该项研究不仅扩展了QTY编码在功能蛋白质设计领域的应用范围,设计的自组装白蛋白纳米载体为临床肿瘤治疗提供新选择。
论文信息:
https://www.pnas.org/doi/10.1073/pnas.2220173120
Run Meng, Shilei Hao *, Changfa Sun, Zongkun Hou, Yao Hou, Lili Wang, Peiying Deng, Jia Deng, Yaying Yang, Haijian Xia, Bochu Wang*, Rui Qing*, and Shuguang Zhang*. Reverse-QTY code design of active human serum albumin self-assembled amphiphilic nanoparticles for effective anti-tumor drug doxorubicin release in mice. PNAS, 2023, 10.1073/pnas.2220173120.